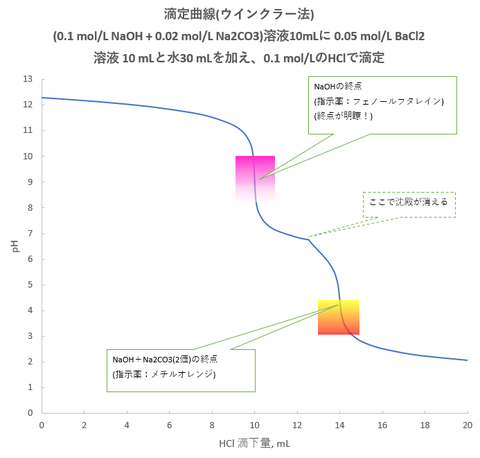
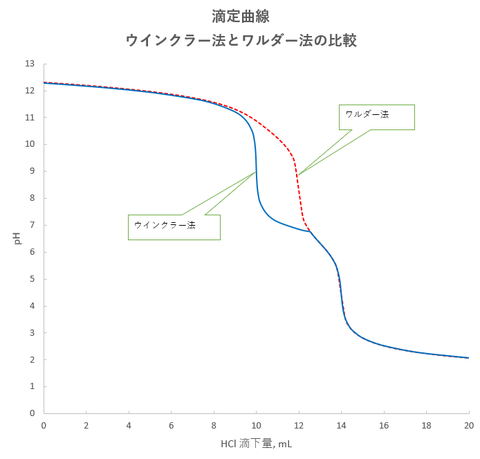
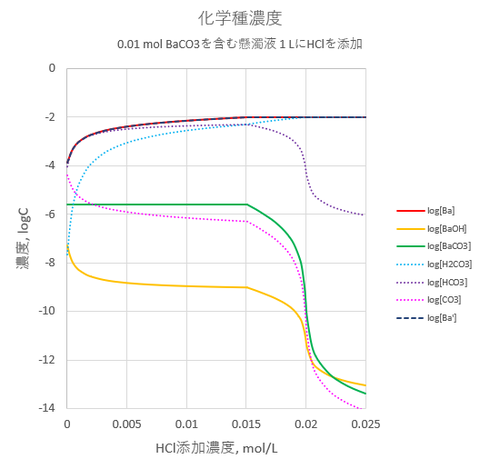
今回は、酢酸-酢酸アンモニウム緩衝液を含む酢酸バリウム((CH3COO)2Ba)溶液にK2CrO4を加えることを考えます。なお、(CH3COO)2BaはBaAc2と略します。
BaAc2, HAc, NH4Ac, K2CrO4の添加濃度をそれぞれ、Cba, Ca, Cn, Ccr (mol/L)とします。
平衡定数は、
Ksp = [Ba][CrO4], pKsp = 9.67
K1 = [H][HCrO4]/[H2CrO4], pK1 = 0.2
K2 = [H][CrO4]/[HCrO4], pK2 = 6.51
Ka = [H][Ac]/[HAc], pKa = 4.76
Kn = [H][NH3]/[NH4], pKn = 9.25
とします。また、活量係数はすべて1とします。
<関係式>
●物質バランス
[CrO4’] = [CrO4]+[HCrO4]+[H2CO4]
Cba-[Ba] = Ccr-[CrO4’]
●電荷バランス
Q = [H]-[OH]+2[Ba]-[HCrO4]-2[CrO4]+[NH4]-[Ac]+[K] = 0
●各化学種の濃度
[H] = 10^-pH
[OH] =10^-14/[H]
[Ba] = Ksp/[CrO4] (沈殿のあるとき)
または、[Ba] = Cba (沈殿のないとき)
[CrO4] = 10^-pCrO4
[HCrO4] = [CrO4][H]/K2
[H2CrO4] = [HCrO4][H]/K1
[NH3] = Cn/(1+[H]/Kn)
[NH4] = [H][NH3]/Kn
[Ac] = (2Cba+Ca+Cn)/(1+[H]/Ka)
[HAc] = [H][Ac]/Ka
[K] = 2Ccr
<エクセルの取り扱い>
●エクセルでのソルバーのパラメータ
・目的セル:電荷バランス、Q = 0
・変数セル:pH, pCrO4
・制約条件:R = Cba-Ccr-([Ba]-[CrO4’]) = 0
●沈殿の生成・消滅の境界におけるパラメータ
・目的セル:電荷バランスQ = 0
・変数セル:pH, pCrO4 およびCcr
・制約条件:R = 0 および [Ba][CrO4]/Ksp = 1
・[Ba]の計算式:[Ba] = Cba
<結果>
結果は次の通りです。
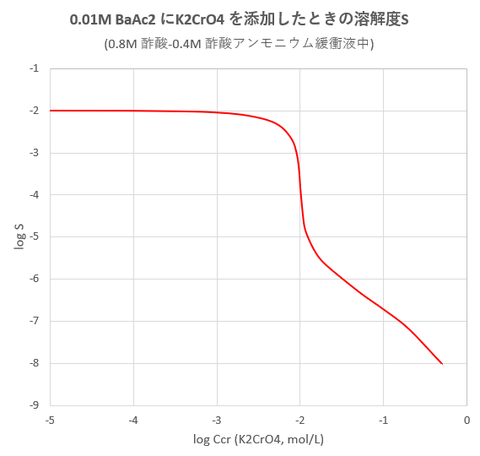
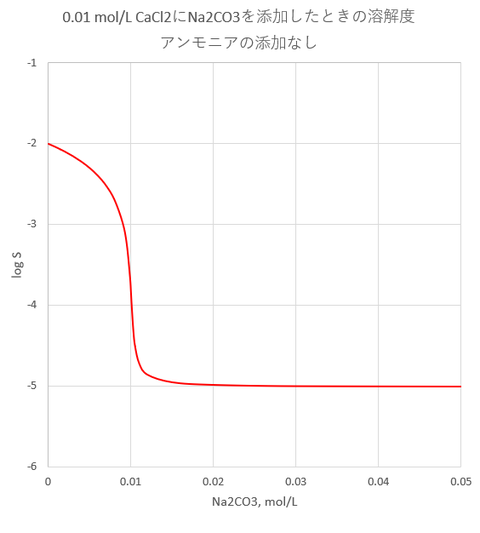
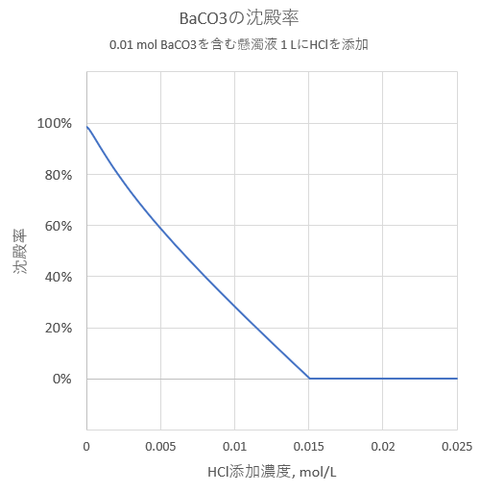
BaAc2, HAc, NH4Acの濃度がそれぞれ、Cba = 0.01mol/L, Ca =0.8 mol/L Cn =0.4 mol/Lの溶液にK2CrO4を添加したときの溶解度を図-1に示します。
K2CrO4の添加濃度がおよそ3×10^-5 mol/L以上で沈殿の生成が始まります。
図-1
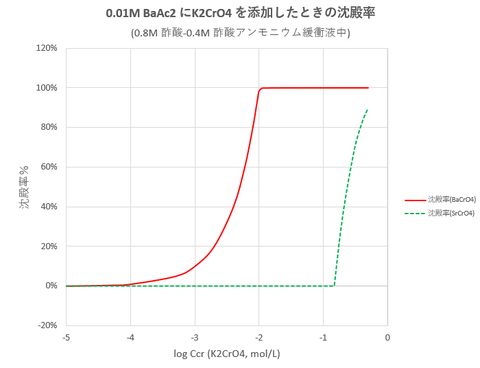
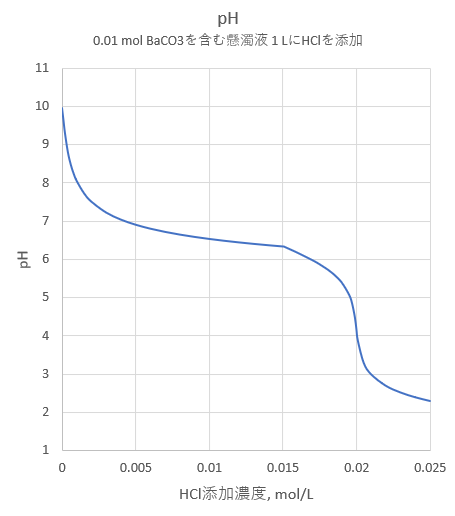
また、K2CrO4を添加の添加濃度と沈殿率の関係を図-2に示します。比較のため、同様にして計算したSrAc2(pKsp=4.65)の沈殿率についても同図に示します。
BaCrO4は、当量よりやや過剰にK2CrO4を添加すれば定量的に沈殿が生成します。一方、SrCrO4は、K2CrO4を大過剰に加えない限り、沈殿は生成しません。したがってK2CrO4を適切に添加すればBa2+とSr2+の分離が可能であることが分かります。
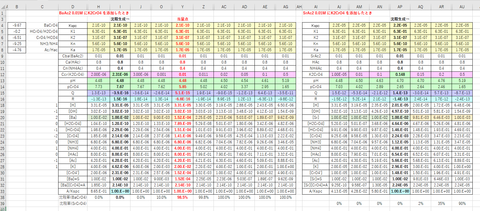
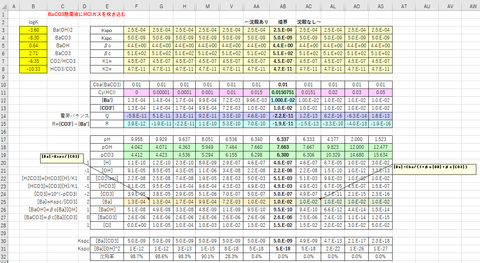
計算例を図-3に示します。
図-3