ソルバーを用いて、CaSO4およびCa(OH)2の純水への溶解度を求めます。平衡定数は熱力学的平衡定数を用い、拡張デバイ-ヒュッケル式で求めた活量係数によって補正を行います(2019-10-20)。
熱力学的平衡定数(K°)、濃度平衡定数(K)、活量係数(γ)の関係は、次の通りです。
⦁CaSO4の溶解度積:
Ksps°= Ksps(γCaγSO4) , Ksps = [Ca][SO4] , pKsps°= 4.62
⦁Ca(OH)2の溶解度積:
Kspo°= Kspo(γCaγOH^2) , Kspo = [Ca][OH]^2 , pKspo°= 5.19
⦁CaSO4(aq)の生成定数:
βs°= βs(γCaSO4/(γCaγSO4)) , βs = [CaSO4(aq)]/([Ca][SO4])
logβs°= 2.36
⦁CaOH+の生成定数:
βo°= βo(γCaOH/(γCaγOH)) , βo = [CaOH]/([Ca][OH])∙
logβo°= 1.3
⦁硫酸の酸解離定数:
K2°= K2(γSO4γH/γHSO4) , K2 = [H][SO4]/[HSO4] , pK2°= 1.99
⦁水のイオン積:
Kw°= Kw(γHγOH) , Kw = [H][OH] , pKw°= 14.00
<<CaSO4の純水への溶解度>>
<関係式>
関係式は次の通り(電荷は省略)。
●物質バランス:(溶解度S)
水への溶解度を考える場合、CaSO4のみが水に溶けているので、
[Ca’] = [Ca]+[CaSO4(aq)] = S
[SO4’] = [HSO4]+[SO4]+[CaSO4(aq)] = S
[SO4’] = [Ca’]
●電荷バランス:
Q = [H]-[OH]+2[Ca]-2[SO4]-[HSO4]
●イオン強度:
μcal = ([H]+[OH]+4[Ca]+4[SO4]+[HSO4])/2
μcal =μo (μo:変数パラメーター)
●活量係数:
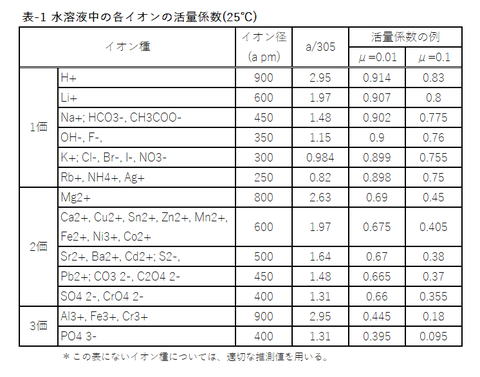
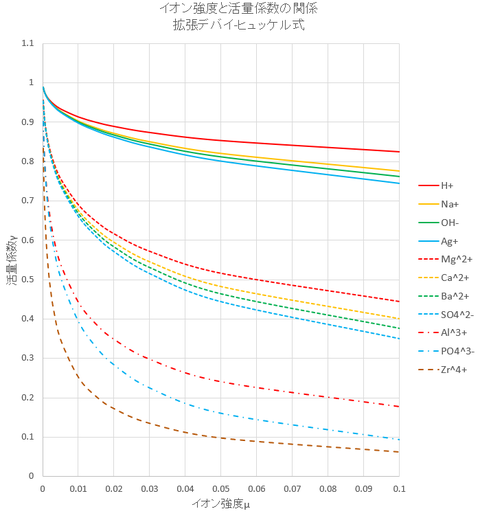
Logγi = -0.51(zi^2)√μo/(1+(ai/305)√μo)
γi = 10^(logγi)
●化学種濃度:
[H] = 10^-pHc
[OH] = Kw/[H]
[Ca] =10^-pCa
[CaSO4(aq)] = βs[Ca][SO4]
[SO4] = Ksp/[Ca]
[HSO4] = [H][SO4]/K2
pH°= pHc-logγH
(pHc, pCa:変数パラメーター)
(CaOH+は無視)
<エクセルシートの作成>
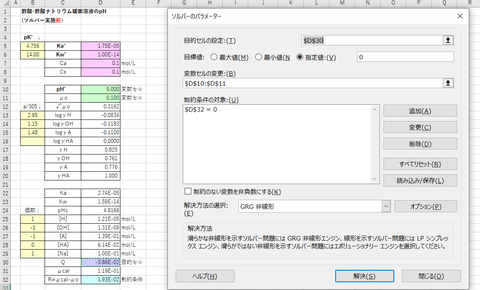
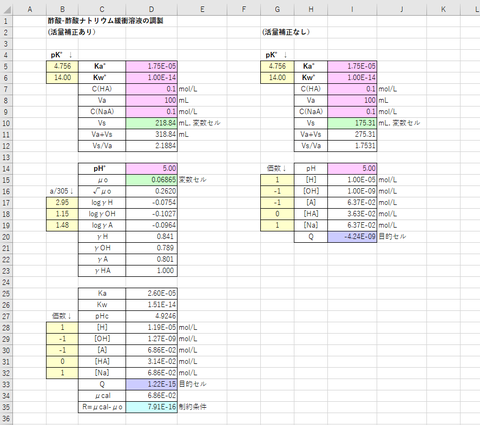
ソルバーのパラメーターを設定する。
・目標セル:Q=0
・変数セル:pHc, pCa, μo
・制約条件:R1= [SO4’]-[Ca’] =0
R2= μcal-μo=0
<計算結果>
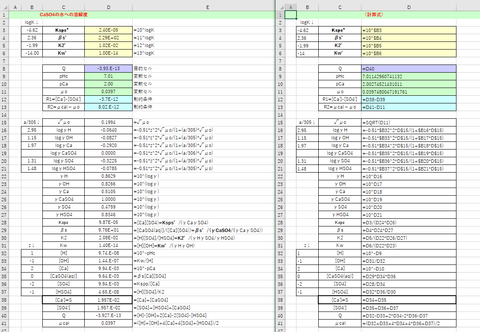
ソルバー解の結果を図-1に示します。計算から求めた溶解度はS=1.96×10^-2 mol/L (2.66g/L)です。この値は実測値(2.7 g/kg (Gypsum & Lime No. 135 (1975), Ⅱ型無水塩))とよく一致しています。ちなみに、活量補正をしなかった場合(γi=1)は、S=1.04×10^-2 mol/Lでした。
図-1
<<Ca(OH)2の純水への溶解度>>
<関係式>
関係式は次の通り(電荷は省略)。
●物質バランス:(溶解度S)
[Ca’] = [Ca]+[CaOH] = S
●電荷バランス:
Q = [H]-[OH]+2[Ca]+[CaOH]
●イオン強度:
μcal = ([H]+[OH]+4[Ca]+[CaOH])/2
μcal =μo (μo:変数パラメーター)
●活量係数:
Logγi = -0.51(zi^2)√μo/(1+(ai/305)√μo)
γi = 10^(logγi)
●化学種濃度:
[Ca] =10^-pCa (pCa:変数パラメーター)
[CaOH] = βo[Ca][OH]
[OH] = √(Kspo/[Ca])
[H] = Kw/[OH]
pH°= pHc-logγH
<エクセルシートの作成>
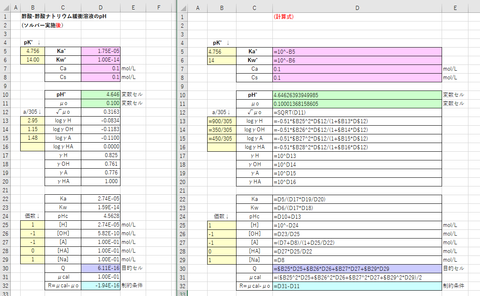
ソルバーのパラメーターを設定する。
・目標セル:Q=0
・変数セル:pCa, μo
・制約条件:R = μcal-μo= 0
<計算結果>
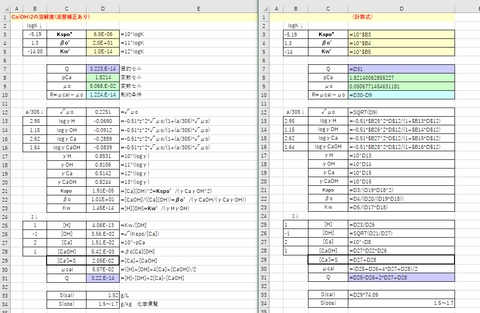
ソルバー解の結果を図-2に示します。計算から求めた溶解度はS=2.05×10^-2 mol/L (1.52g/L)です。この値は実測値(1.49~1.70 g/kg(化学便覧))とよく一致しています。ちなみに、活量補正をしなかった場合(γi=1)は、S=1.52×10^-2 mol/Lでした。
図-2