前回(2019/12/22)のブログで、硫化水素の飽和溶液に対するZnSの溶解度を求めました。今回は一定量の沈殿剤(具体的には硫化ナトリウムやチオアセトアミドなど)を加えた溶液に対するZnSの溶解度を求めます。
用いた平衡定数は前回(2019/12/22)通りです。添加した沈殿剤のS濃度をCs=0.1mol/Lとし、ZnSの溶解度をsとすると、溶解度の算出方法は、次の通りです。
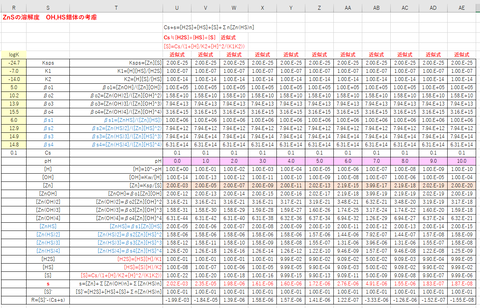
<ソルバーによる解法>
●物質バランスは、
[Zn’ ]= [Zn]+Σ[Zn(OH)n]+Σ[Zn(HS)n] = s
[S’ ]= [H2S]+[HS]+[S]+Σn[Zn(HS)n] = Cs+s …①
R= [S’]-(Cs+s) = 0
●化学種濃度は、
[H] = 10^-pH
[OH] = Kw/[H]
[Zn] = Ksp/[S]
[ZnOH] = βo1[Zn][OH]
[Zn(OH)2]= βo2[Zn][OH]^2
[Zn(OH)3]= βo3[Zn][OH]^3
[Zn(OH)4]= βo4[Zn][OH]^4
[ZnHS] = βs1[Zn][HS]
[Zn(HS)2]= βs2[Zn][HS] ^2
[Zn(HS)3]= βs3[Zn][HS] ^3
[Zn(HS)4]= βs4[Zn][HS] ^4
[H2S] = 初期値 (たとえば、pH0のとき[H2S]の初期値を0.1 mol/L とする)
[HS] = [H2S]K1/[H]
[S] =[HS]K2/[H]
●パラメーター、
目的セル:R = [S’]-(Cs+s)
変数セル:[H2S]
変化させる条件:pH (pHの値を変えながら、各pHごとにソルバー解を求める)
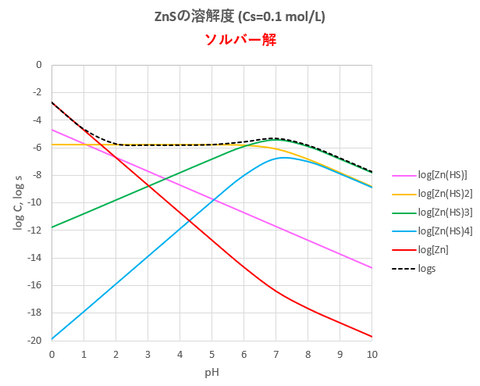
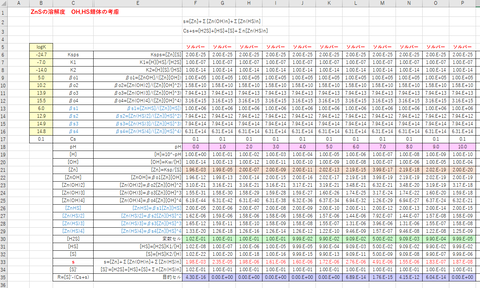
結果を図-1に示す。エクセルシートの例を図-2に示す。
図-1(沈殿剤添加量一定(Cs =0.1 mol/L)の溶液に対する
ZnSの溶解度)
図-2
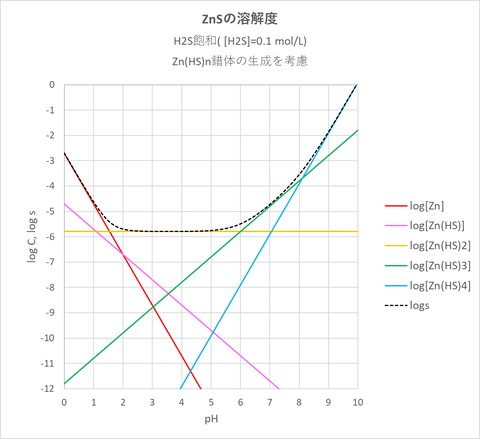
なお比較のため、H2Sを常に飽和させた溶液に対する溶解度を図-3に示す(既出:前回の図-2)。
図-3(H2Sを常に飽和させた溶液に対するZnSの溶解度)
図-1、図-3を比較してみると、酸性領域(pHおよそ0~5)ではCs=0.1mol/Lの溶液に対するZnSの溶解度はH2Sの飽和溶液の場合とほぼ同じですが、中性・塩基性領域(およおpH>5)では、溶解度の様子が異なります。Cs=0.1mol/L溶液の場合はH2Sの飽和溶液と異なり、中性・塩基性において溶解度の極端な上昇は見られません。これは中性・塩基性領域においては両者の溶液中のHS-濃度(2019/12/01)が異なるためZn(HS)nの生成濃度が異なるためです。実際の実験でもこのような現象が起きますが、Zn(HS)nの生成が原因と思われます。
<近似式による解法>
各pHごとにソルバーを用いて解を求めるのはなかなか面倒なので、いくつかの仮定を設けて①式を単純化した近似式を作り、ソルバーを用いないでも通常の表計算だけで溶解度を求めることができる方法を考えます。
まず、ZnSは難溶性塩であり、その溶解度は非常に小さいので、比較的過剰量のCsが添加されるとCs>>sとなり、①式の右辺は次のように近似できると考えられます。
(Cs+s)≒Cs
また、①式の左辺で、Σn[Zn(HS)n]の値は非常に小さく、[H2S]+[HS]+[S]に比べて無視できると考えられます。
これらの仮定から、
[H2S]+[HS]+[S] = Cs …①’
が得られます(これらの仮定の妥当性は後で検証する)。
したがって、①’およびK1, K2から、
[S][H]^2/(K1K2)+[S][H]/K2+[S] = Cs
[S](1+[H]/K2+[H]^2/(K1K2)) = Cs
したがって、
[S]= Cs/(1+[H]/K2+[H]^2/(K1K2))
[HS]= [S]K2/[H]
[H2S]= [HS]K1/[H]
となり、pHを与えると[OH], [Zn], [ZnOH], [Zn(OH)2], [Zn(OH)3], [Zn(OH)4],[ZnHS], [Zn(HS)2], [Zn(HS)3], [Zn(HS)4], [S], [HS], [H2S]の値がすべて一義的に決まり、溶解度は
s= [Zn]+Σ[Zn(OH)n]+Σ[Zn(HS)n]
となります。
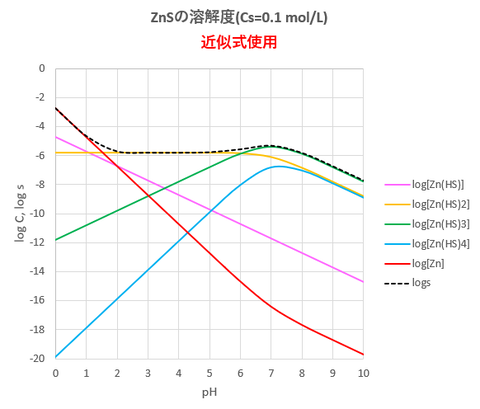
結果を図-4, 図-5に示します。
図-4
図-5
図-1と図-4(あるいは図-2と図-5)を比較すると、近似式①’の使用はpH1~10においてほぼ妥当と思われます。
コメント