酸・塩基の滴定曲線を描く方法として、これまで、主に「二分法」(2019-03-07) (2019-03-08)を用いてきましたが、今回は「レビ法」(2019-03-12)についてもう少し詳しく説明します。
「レビ法」は最初にpHを与えてそのpHにおける滴定剤の体積Tを求めて滴定曲線を描く方法です*1。
*1) R. de Levie, J. Chem. Ed., 76,987 (1999); 宗林由樹 監訳「ハリス分析化学[原著9版](上)」化学同人 (2017) 317ページ
●3価の弱酸(リン酸)
Cao mol/L, V mLの3価の弱酸(H3A, たとえばリン酸)をCbo mol/LのNaOHで滴定する(滴下量:T mL)ことを考えます。
酸塩基平衡および酸解離定数は、
H3A ⇄ H2A-+ H+ K1= [H2A-][H+]/[H3A]
H2A-⇄ HA2- + H+ K2= [HA2-][H+]/[H2A-]
HA2- ⇄ A3-+ H+ K3 = [A3-][H+]/[HA2-]
滴定途中の溶液中におけるリン酸およびNaOHの全濃度をCa, Cbとすると、
Ca = CaoV/(V+T)
Cb = CboT/(V+T)
このときの化学種濃度は、
[H+] = 10^-pH
[OH-] = Kw/[H+]
[Na+] = Cb =CboT/(V+T)
[A3-] = Caf0= Caof0V/(V+T)
[HA2-] = Caf1 = Caof1V/(V+T)
[H2A-]= Caf2 = Caof2V/(V+T)
[H3A] = Caf3= CaoVf3/(V+T)
ここで、fiは化学種HiA (iは解離することのできるHの数)の存在分率
Ca = [A3-]+[HA2-]+[H2A-]+[H3A]= [A3-](1+[H+]/K3+[H+]^2/(K3K2)+[H+]^3/(K3K2K1))
ここで、α = 1+[H+]/K3+[H+]^2/(K3K2)+[H+]^3/(K3K2K1) とすると、
Ca =[A3-]α
f0= [A3-]/Ca = 1/α (Hの数は0、電荷は-3)
f1= [HA2-]/Ca = [H+]/(K3α) (Hの数は1、電荷は-2)
f2= [H2A-]/Ca =[H+]^2/(K3K2α) (Hの数は2、電荷は-1)
f3= [H3A]/Ca = [H+]^3/(K3K2K1α) (Hの数は3、電荷は0)
電荷バランスは、
Q = [H+]-[OH-]+[Na+]-3[A3-]-2[HA2-]-[H2A-] =0
Δ = [H+]-[OH-]とすると、
Δ+CboT/(V+T)-3Caof0V/(V+T)-2Caof1V/(V+T)-Caof2V/(V+T) = 0
両辺に(V+T)を掛けて、
Δ(V+T)+CboT-3Caof0V-2Caof1V-Caof2V= 0
TとVで整理して、
T(Δ+Cbo)+V(Δ-Cao(3f0+2f1+f2)) = 0
したがって、3価の弱酸(たとえば、リン酸)をNaOHで滴定の場合、
T = V(Cao(3f0+2f1+f2)-Δ)/(Cbo+Δ) …①
この式がpHから滴下量(T mL)を求める式となります。
具体的には、pHを与えると、[H+], [OH-](=Kw/[H+])が分かり、Δが求まります。また、[H+]およびK3, K2, K1からαを求めると、化学種の分率f0, f1, f2が求まります*2。
したがって、V, Cao,Cboが既知の場合、pHを与えると①式からTの値を求めることができます。Tに対してpHをプロットすると滴定曲線が描けます。
*2) 無電荷の化学種に対するfiは不要。たとえばリン酸のようにH3Aが分子形で無電荷の場合、H3Aの分率f3は不要となる。
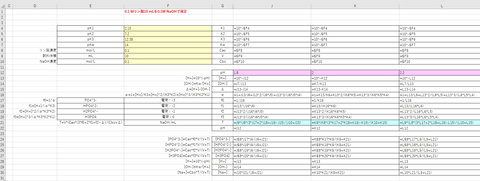
pK1=2.15, pK2=7.20,pK3=12.38として(活量係数は無視)、Cao=0.1mol/L, V=10 mLのリン酸をCbo=0.1 mol/LのNaOHで滴定したときの滴定曲線および化学種濃度を図-1に示します(滴下量:T mL)。また、このときのエクセル表の抜粋を図-2, 図-3に示します。
図-1(滴定曲線)
図-2(結果の抜粋)
滴定開始、当量点における、T→pHの算出には、ソルバーを用いた。
図-3(計算式)
●2価の弱酸(シュウ酸)
2価の弱酸(H2A)をNaOHで滴定する場合も、考え方は上記と同じです。
H2A ⇄ HA-+ H+ K1 = [HA-][H+]/[H2A]
HA- ⇄ A2-+ H+ K2 = [A2-][H+]/[HA-]
[H+] = 10^-pH
[OH-] = Kw/[H+]
[A2-] = Caf0= Caof0V/(V+T)
[HA-]= Caf1 = Caof1V/(V+T)
[H2A] = Caf2= Caof2V/(V+T)
[Na+] = Cb = CboT/(V+T)
α = 1+[H+]/K2+[H+]^2/(K2K1)
f0 = [A2-]/Ca= 1/α (Hの数は0、電荷は-2)
f1 = [HA-]/Ca= [H+]/(K2α) (Hの数は1、電荷は-1)
f2 = [H2A]/Ca=[H+]^2/(K2K1α) (Hの数は2、電荷は0)
Q = [H+]-[OH-]+[Na+]-2[A2-]-[HA-] = 0
Δ(T+V)+CboT-2Caof0V-Caof1V = 0
T(Cbo+Δ)-(VCao(2f0+f1)-Δ) = 0
したがって、2価の弱酸(たとえば、シュウ酸)をNaOHで滴定の場合、
T = V(Cao(2f0+f1)-Δ)/(Cbo+Δ) …②
0.1 mol/L, 10 mLのリン酸を0.1 mol/LのNaOHで滴定したときの滴定曲線を図-4に示します(滴下量:T mL)。
図-4
●1価の弱酸(酢酸)
HA ⇄ A- + H+ Ka =[A-][H+]/[HA]
[H+] = 10^-pH
[OH-] = Kw/[H+]
[Na+] = Cb = CboT/(V+T)
[A-] = Caf0= Caof0V/(V+T)
[HA] = Caf1= Caof1V/(V+T)
α = 1+[H+]/Ka
f0= [A-]/Ca = 1/α = Ka/([H+]+Ka) (Hの数は0、電荷は-1)
f1= [HA]/Ca = [H+]/(Kaα) = [H+]/([H+]+Ka) (Hの数は1、電荷は0)
Q = [H+]-[OH-]+[Na+]-[A-] = 0
Δ(T+V)+CboT-Caof0V= 0
したがって、1価の弱酸(たとえば、酢酸)をNaOHで滴定の場合、
T = V(Caof0-Δ)/(Cbo+Δ) …③
●1価の強酸(塩酸)
[H+] =10^-pH
[OH-]= Kw/[H+]
[A-]= Ca = CaoV/(V+T)
[Na+]= Cb = CboV/(V+T)
Q = [H+]-[OH-]+[Na+]-[A-] = 0
したがって、1価の強酸(たとえば、塩酸)をNaOHで滴定の場合、
T = V(Cao-Δ)/(Cbo+Δ) …④
以上述べたように「レビ法」を用いると、「二分法」と違って特別な計算表を作らなくても①~④という計算式だけでpHからTを求めることができ、簡単に滴定曲線が描けます。ただし、特定のTに対するpHを求めることはできません。もしそうしたいときは(たとえば、T=0のときのpHや当量点におけるpHなど)、「ゴールシーク」あるいは「ソルバー」を用いる必要があります。



コメント