キレート滴定の代表であるEDTA滴定について、滴定曲線を描くため基本的な関係式を導きます。
<EDTAの酸としての性質>
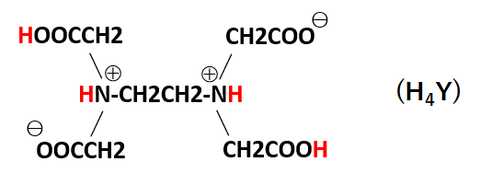
中性形のEDTA(H4Y)は4価の酸と考えることができます(下図)。(*1)
H4Yは次のように酸解離します。
H4Y ⇄ H3Y- + H+ K1 = [H3Y][H]/[H4Y]
H3Y- ⇄ H2Y2- + H+ K2 = [H2Y][H]/[H3Y]
H2Y2- ⇄ HY3- + H+ K3 = [HY][H]/[H2Y]
HY3- ⇄ Y4- + H+ K4 = [Y][H]/[HY]
(*1) すべてがプロトン化したH6Y2+は6価の酸となる。しかし、H6Y2+, H5Y+形のイオンは主に強酸性溶液中でのみ存在する。実際のEDTA滴定は塩基性側で行われることが多く、EDTA滴定の考察には重要でないのでここでは考えない。ちなみに、EDTAの遊離酸(H4Y)の溶解度は非常に小さく水に溶けにくいので、滴定試薬としては2ナトリウム塩がよく使用される。
EDTAの全濃度を[Y’]とすると、
[Y’]= [Y]+[HY]+[H2Y]+[H3Y]+[H4Y]
=[Y](1+[H]/K4+[H]2/(K4K3)+[H]3/(K4K3K2)+[H]4/(K4K3K2K1))
なので、
α = 1+[H]/K4+[H]2/(K4K3)+[H]3/(K4K3K2)+[H]4/(K4K3K2K1)
として、
[Y’]= [Y] α
したがってEDTAの化学種(Y4-,HY3-, H2Y2-, H3Y-, H4Y)の存在分率(fn)は、
f0= [Y]/[Y’] = 1/α
f1= [HY]/[Y’] = f0[H]/K4
f2= [H2Y]/ [Y’] = f0[H]2/(K4K3)
f3= [H3Y]/[Y’] = f0[H]3/(K4K3K2)
f4= [H4Y]/[Y’] = f0[H]4/(K4K3K2K1)
となります。(*2)
(*2) fxは各化学種の存在分率(xは解離できるHの数)。fxは[H]のみの関数であり、EDTAの全濃度とは無関係となることに注意! また、ここで用いた fxにαという記号を用いる場合も多い。
pH変化にともなうEDTAの化学種分布を図-1に示します(pK4=10.37, pK3=6.13, pK2=2.69, pK1=2.00)。図-1から明らかなように、たとえば、Y4-の分率f0はpH10では0.30、pH12では0.98となります。
図-1
<EDTA錯体と条件生成定数>
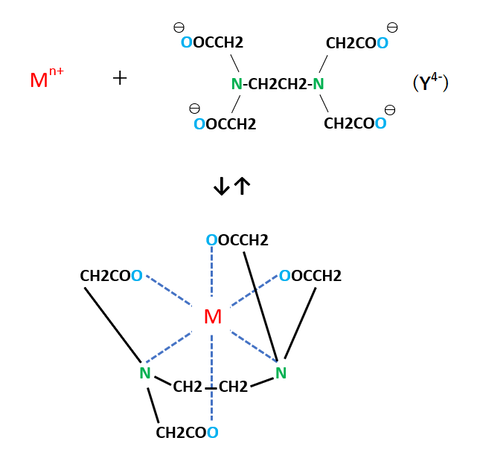
水素イオンがすべて解離したY4-は金属イオンMn+と安定なキレートを生成することができます。
このキレート環は非常に安定した構造をとり、EDTAはアルカリ金属イオン以外のほとんどの金属イオンと1:1の安定な錯体を作ります。
Mn+ + Y4- ⇄ MYn-4
Kf = [MY]/([M][Y])
Kfは金属イオンMn+とY4-からEDTA錯体MYn-4が生成するときの平衡定数です。
ここで、上記のf0 = [Y]/[Y’] = 1/αから[Y]= [Y’]f0なので
Kff0 = [MY]/([M][Y’])
このKff0をKf’とすると、
Kf’ =[MY]/([M][Y’])
となります。
α = 1+[H]/K4+[H]2/(K4K3)+[H]3/(K4K3K2)+[H]4/(K4K3K2K1) なので、f0 = 1/αは[H]のみの関数であり、pHが一定ならばKf’は一定です。Kf’は条件生成定数と呼ばれます。(*3)
(*3) 実際には、条件生成定数は金属イオンMの加水分解やその他の副反応も考慮する必要があるが、滴定曲線の関係式を求めるにあたっては無視する。金属イオンMの副反応等を考慮した条件生成定数については、最後に述べる。
<滴定曲線の関係式>
金属イオンMを含む溶液について、pH緩衝液を用いてpHを一定にしてEDTAで滴定することを考えます。
Cmo mol/Lの金属イオンMを含む溶液Vm mLに緩衝液を加えてV mLにしたあと、Cyo mol/LのEDTAで滴定するとき(滴下量:T mL)の滴定曲線の関係式を求めます。
関係式は次のとおり。
Mn+ + Y4- ⇄ MYn-4
Kf = [MY]/([M][Y])
[MY] = Kf[M][Y] …①
Kf’ = Kff0 …②
各滴定段階における溶液中のEDTAと金属イオンMの全濃度をCy , Cmとすると、
Cm, CyとCmo, Cyoの間には次の関係があります。
Cm= CmoVm/(V+T) …③
Cy = CyoT/(V+T) …④
また、物質バランスから、
Cm = [M]+[MY] …⑤
Cy= ([Y]+[HY]+[H2Y]+[H3Y]+[H4Y])+[MY] …⑥
<滴定曲線の描き方>
滴定曲線を描くためには、TとpM(=-log[M])の関係を求める必要があります。
1) pMを与えてTを求める方法
EDTAの物質バランス(⑥式)および生成定数式(①式)から
Cy = ([Y]+[HY]+[H2Y]+[H3Y]+[H4Y])+Kf[M][Y] = [Y’]+Kf[M][Y]
[Y’] /[Y] = 1/f0なので、
Cy = [Y](1/f0+Kf[M])
[Y] = Cyf0/(1+f0Kf[M])
[Y] =Cyf0/(1+Kf’[M]) …⑦
また、金属イオンMの物質バランス(⑤式)および⑦式から、
Cm =[M]+Kf’[M]Cy/(1+Kf’[M])
Cy=(Cm-[M])(1+Kf’[M])/(Kf’[M]) …⑧
③, ④式を⑧式に代入して、
CyoT/(V+T) = (CmoVm/(V+T)-[M])(1+Kf’[M])/(Kf’[M]) …⑨
⑨式をTについて整理すると、
T = {(CmoVm-[M]V)(1+Kf’[M])}/{[M](1+Kf’[M]+Kf’Cyo)} …⑩
この式がpMを与えてTを求めるときの関係式です(滴下量:T (mL), 遊離のMイオン濃度:[M](mol/L))。
緩衝液を加えて溶液のpHを一定に保つとf0が求まり、Kf’が与えられます。pMの値を与えると[M]=10-pMからTを求めることができ、滴定曲線(T-pM)を描くことができます。
2) Tを与えてpMを求める方法
別法として、⑧式を[M]について整理すると[M]に関する二次方程式が得られます。
Kf’[M]2-(Kf’(Cm-Cy)-1)[M]-Cm = 0
[M]2+(Cy-Cm+1/Kf’)[M]-Cm/Kf’ = 0 …⑪
Tを与えて③, ④式からCm , Cyを求め、これを⑪に代入し、二次方程式の解の公式により[M]を求めることができます。
[M] = {-(Cy-Cm+1/Kf’)+√((Cy-Cm+1/Kf’)2+4Cm/Kf’)}/2 …⑫
Cm = CmoVm/(V+T) …③
Cy = CyoT/(V+T) …④
<滴定曲線の例>
Cmo=0.01 mol/Lの金属イオン(logKf=10とする)を含む溶液Vm=20 mLに緩衝液(pH=12)を加えてV=50 mLにしたあと、Cyo 0.01 mol/LのEDTAで滴定したとき(滴下量:T mL)の滴定曲線の例を図-2に示します(pMを与えてTを求める方法)。T=0, 20のときのpMはソルバーを用いて求めました。
図-2
<条件生成定数について>
以上の取り扱いにおいては、条件生成定数を
Kf’ = [MY]/([M][Y’])
として、滴定曲線の関係式(T-pM)を導きました。
つまり、金属イオンMn+と結合していない遊離のEDTAに関して、H4Y, H3Y-, H2Y2-,HY3-, Y4-の5種類の化学種が存在することを考慮していますが、Y4-と結合していない金属イオンとしては、Mn+だけしか想定していません。
しかし、実際には、Y4-と結合していない金属化学種としてはMn+以外にもM(OH), M(OH)2,…といった水酸化物や他の配位子Lと結合したML, ML2,…といった化学種が存在する場合もあります。
したがって、このような場合、
[M’] = [M]+[MOH]+[M(OH)2]+…+[ML]+[ML2]+…
として、新たな条件生成定数Kf’’を考える必要があります。
Kf’’ = [MY]/([M’][Y’])
さらに、MYについても、場合によってMHYやM(OH)Yといった化学種も生成するので、このような場合は、
[MY’] = [MY]+[MHY]+[M(OH)Y]+…
Kf’’’ = [MY’]/([M’][Y’])
を用いる必要があります。
このような複雑な平衡を解析するときは上記の関係式(⑩または⑫)だけでは不十分であり、エクセルのソルバーの使用が有効となります。


コメント