今回は多価の酸・塩基の緩衝液について、ソルバーを用いてpHを求めます。計算にあたっては活量係数を考慮します。
いくつかの例について、活量係数を考慮して緩衝液のpHを求めます。Kºは熱力学的平衡定数、pHºは活量基準のpHを表します。活量係数による補正には拡張デバイヒュッケル式を用います。化学種iの拡張デバイヒュッケル式は次の通りです。
logγi= -0.51(zi^2)√µ/(1+(ai/305)√µ)
ここで、γiは活量係数、μはイオン強度、ziは電荷、aiは水和イオン直径(pm)を表します。
例題1:0.1 mol/Lのフタル酸水素カリウム(KHPh) 50
mLに0.1 mol/LのNaOH 25 mLを加えて水で100 mLにした溶液のpHºは? フタル酸の酸解離定数をpK1º=2.95, pK2º=5.41とし、水のイオン積をKwº=14.00とする。
緩衝液中のフタル酸水素カリウムの濃度をCaとし、NaOHの濃度をCbとすると関係式は次の通り。
・平衡定数:
K1 = K1º/(γHγHPh/γH2Ph)
K2 = K2º/(γHγPh/γHPh)
Kw = Kwº/(γHγOH)
・活量係数:
logγH= -0.51√µ/(1+2.95√µ)
logγOH= -0.51√µ/(1+1.15√µ)
logγH2Ph= 0
logγHPh= -0.51√µ/(1+1.97√µ)
logγPh= -0.51×4√µ/(1+1.97√µ)
µ = ([H]+[OH]+4[Ph]+[HPh]+[K]+[Na])/2
・物質収支:
Ca = [Ph]+[HPh]+[H2Ph]
= [K]
Cb = [Na]
・電荷収支:
Q = [H]-[OH]-2[Ph]-[HPh]+[K]+[Na] = 0
・化学種濃度:
[H]º = [H]γH
pH = pHº+logγH
[H] = 10^-pH
[OH] = [H]/Kw
[Ph] = Ca(1+[H]/K2+[H]^2/(K2K1))
[HPh] = [H][Ph]/K2
[H2Ph] = [H][HPh]/K1
[K]+[Na] = Ca+Cb
これらの関係式から、ソルバーを用いて
・目的セル:Q=0
・変数セル:pHº, μo
・制約条件:μo-μ=0
としてpHºを求めると、結果は図-1のようになる。
(答) pHº = 5.12
例題2:0.1 mol/Lのリン酸二水素カリウム 50 mLに0.1 mol/LのNaOH 30 mLを加えて水で100 mLにした溶液のpHºは? リン酸の酸解離定数をpK1º=2.15, pK2º=7.20, pK3º=12.38とし、水のイオン積をKwº=14.00とする。
緩衝液中のリン酸二水素カリウムの濃度をCa、NaOHの濃度をCbとすると関係式は次の通り。
・平衡定数:
K1 = K1º/(γHγH2PO4/γH3PO4)
K2 = K2º/(γHγHPO4/γH2PO4)
K3 = K3º/(γHγPO4/γHPO4)
Kw = Kwº/(γHγOH)
・活量係数:
logγH= -0.51√µ/(1+2.95√µ)
logγOH= -0.51√µ/(1+1.15√µ)
logγH3PO4= 0
logγH2PO4= -0.51√µ/(1+1.48√µ)
logγHPO4= -0.51×4√µ/(1+1.31√µ)
logγPO4= -0.51×9√µ/(1+1.31√µ)
µ = ([H]+[OH]+9[PO4]+4[HPO4]+[H2PO4]+[K]+[Na])/2
・物質収支:
Ca = [PO4]+[HPO4]+[H2PO4]+[H3PO4]
= [K]
Cb = [Na]
・電荷収支:
Q = [H]-[OH]-3[PO4]-2[HPO4]-[H2PO4]+[K]+[Na] = 0
・化学種濃度:
[H]º = [H]γH
pH = pHº+logγH
[H] = 10^-pH
[OH] = [H]/Kw
[PO4] = Ca(1+[H]/K3+[H]^2/(K3K2)+[H]^3/(K3K2K1))
[HPO4] = [H][PO4]/K3
[H2PO4] = [H][HPO4]/K2
[H3PO4] = [H][H2PO4]/K1
[K]+[Na] = Ca+Cb
これらの関係式から、ソルバーを用いて
・目的セル:Q=0
・変数セル:pHº, μo
・制約条件:μo-μ=0
としてpHºを求めると、結果は図-2のようになる。
(答) pHº = 7.02
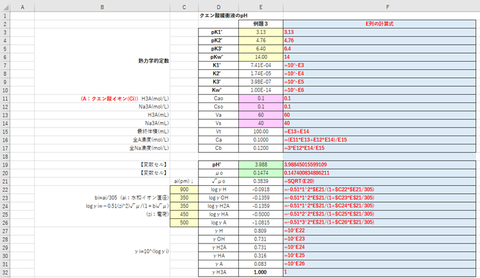
例題3:0.1 mol/Lのクエン酸(H3Ci) 60
mLに0.1 mol/Lのクエン酸三ナトリウム(Na3Ci) 40 mLを加えた溶液のpHºは? クエン酸の酸解離定数をpK1º=3.13, pK2º=4.76, pK3º=6.40とし、水のイオン積をKwº=14.00とする。
緩衝液中のクエン酸の濃度をCa、クエン酸三ナトリウムの濃度をCbとすると関係式は次の通り。
・平衡定数:
K1 = K1º/(γHγH2Ci/γH3Ci)
K2 = K2º/(γHγHCi/γH2Ci)
K3 = K3º/(γHγCi/γHCi)
Kw = Kw/(γHγOH)
・活量係数:
logγH= -0.51√µ/(1+2.95√µ)
logγOH= -0.51√µ/(1+1.15√µ)
logγH3Ci= 0
logγH2Ci= -0.51√µ/(1+1.15√µ)
logγHCi= -0.51×4√µ/(1+1.48√µ)
logγCi= -0.51×9√µ/(1+1.64√µ)
µ = ([H]+[OH]+9[Ci]+4[HCi]+[H2Ci]+[Na])/2
・物質収支:
Ca+Cb = [Ci]+[HCi]+[H2Ci]+[H3Ci]
3Cb = [Na]
・電荷収支:
Q = [H]-[OH]-3[Ci]-2[HCi]-[H2Ci]+[Na]
= 0
・化学種濃度:
[H]º = [H]γH
pH = pHº+logγH
[H] = 10^-pH
[OH] = [H]/Kw
[Ci] = (Ca+Cb)/(1+[H]/K3+[H]^2/(K3K2)+[H]^3/(K3K2K1))
[HCi] = [H][Ci]/K3
[H2Ci] = [H][HCi]/K2
[H3Ci] = [H][H2Ci]/K1
[Na] = 3Cb
これらの関係式から、ソルバーを用いて
・目的セル:Q=0
・変数セル:pHº, μo
・制約条件:μo-μ=0
としてpHºを求めると、結果は図-3のようになる。
(答) pHº = 3.99




コメント