前回(2022-05-01)は弱酸の分配平衡について調べましたが、今回は塩基および両性化合物について調べます。
<<塩基の分配平衡>>
塩基の分配平衡も、酸の場合と同様に取り扱うことができます。アルキルアミン(RNH2)を例にとって考えます。RNH2の分配定数をKdとし、酸解離定数をKaとします。有機相中でRNH2は解離せず、また二量体の生成などもないものとします。
アルキルアミン(RNH2)をBとすると、分配平衡は、
Bw ⇄
Bo
Kd = [B]o/[B]w
水相でBwは、
HB+w ⇄ Bw + H+
Ka = [H+][B]w/[HB+]w
このとき分配比は、
D = [B]o/([B]w+[HB+]w) …①
となります。
①式の分子分母を[B]wで割ると、
D = ([B]o/[B]w)/(1+[HB+]w/[B]w)
= Kd/(1+[H+]/Ka) …①'
したがって、Dは[H+]の関数となることが分かります。
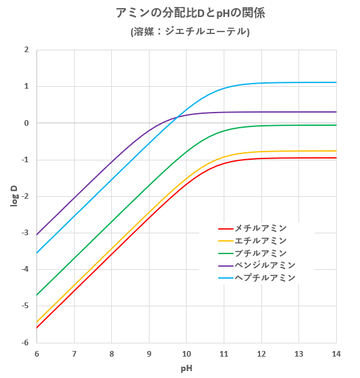
幾種類かのアルキルアミンのジエチルエーテルに対するKdとKaを下表に示します。
これらのアミンについて、pHとlogDと関係を図-1に示します。
図-1からも明らかなように、
・pHが低いとき(およそpH<9~10)は、[H+]/Ka>>1となり、
D = Kd[H+]/Ka
となり、logD傾き1の直線となります。
・pHが高いとき(およそpH>10~11)は、[H+]/Ka<<1となり、
D = Kd
となります。
また、アルキル基の式量の増加とともにDは増加していることが分かります。
<<両性化合物の分配平衡>>
両性化合物の例として、金属イオンの溶媒抽出によく用いられるオキシン(8-ヒドロキシキノリン)(HQ)を例にとって考えます。オキシンは分子内にヒドロキシ基とイミノ基を持ち、酸と塩基の性質を持っています。
HQの酸解離定数をKa1, Ka2とし、クロロホルム(*1)に対する分配定数をKdとします。有機相ではRNH2は解離せず、また二量体の生成などもないものとします。
(*1) クロロホルム、四塩化炭素などの塩素系溶剤は健康への影響(肝臓障害、発がん性など)や環境への影響(オゾン層の破壊)が問題となっており、その使用は極力さけるべきであろう。
分配平衡は、
HQw ⇄ HQo
Kd = [HQ]o/[HQ]w
水相でHQwは、
H2Q+w ⇄ HQw +
H+
Ka1 = [H+][HQ]w/[H2Q+]w
HQw ⇄ Q-w + H+
Ka2 = [H+][Q-]w/[HQ]w
このとき分配比は、
D = [HQ]o/([H2Q+]w+[HQ]w+[Q-]w) …②
となります。
②式の式の分子分母を[HQ]wで割ると、
D = ([HQ]o/[HQ]w)/([H2Q+]w/[HQ]w+1+[Q-]w/[HQ]w)
D = Kd/([H+]/Ka1+1+Ka2/[H+]) …②'
したがって、Dは[H+]の関数となることが分かります。
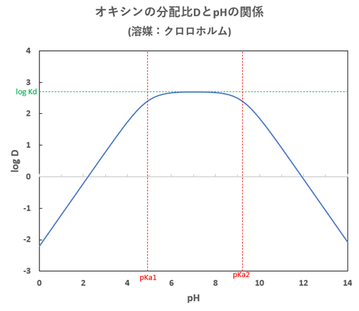
オキシンのクロロホルムに対する平衡定数をKd=10^2.7, Ka1=10^-4.92,
Ka2=10^-9.23として、pHとlogDと関係を図-2に示します。
図-2からも明らかなように、
・酸性が強いとき(pH≲pKa1)は、
D
= Kd/([H+]/Ka1)
log D = pH+log Kd-pKa1 (傾き1の直線)
・中間域(pKa1≲pH≲pKa2)では、
D = Kd (水平線)
・塩基性が強いとき(pH≳pKa2)は、
D
= Kd/(Ka2/[H+])
log
D =-pH+log Kd+pKa2 (傾きー1の直線)
となります。
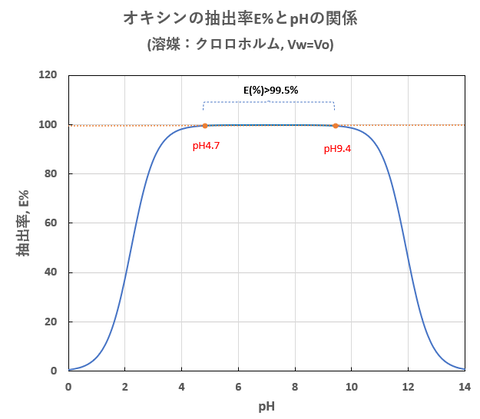
また、抽出率は次式で与えられますが、
E(%) = D/(D+Vw/Vo)×100
Vw=VoとしたときのpHと抽出率(E%)の関係を図-3に示します。
オキシンはpH4.7~9.4の間でほぼ完全に(99.5%以上)クロロホルムに抽出されることがわかります。


コメント