滴定剤用のNaOH溶液を調製するにあたっては、できる限り炭酸塩を含まないような調製法をとる必要があります。また滴定剤の保存および使用においても大気中のCO2との接触をできるだけ避ける工夫が必要です*1)。今回は、CO2で汚染したNaOHを滴定剤として用いた場合の滴定曲線と滴定誤差について調べます。
*1) NaOHは固体・溶液に限らず大気中のCO2を吸収して炭酸塩で汚染される危険性を持っている。JIS等に記載されている滴定剤用のNaOH溶液の調製・標定方法は次の通り:
「使用する水は、煮沸して溶存気体及び二酸化炭素を除去した後、ソーダ石灰を詰めた二酸化炭素吸収管を接続して保存する。CO2を含まないNaOH溶液を作るためには、市販のNaOH試薬に含まれるNa2CO3(試薬の保管中に空気中のCO2を吸収する場合もある)を除くため、まずNaOH濃度約50%の濃厚水溶液を作り数日放置してNa2CO3を沈降させる(NaOHの濃厚水溶液にNa2CO3は不溶)。目的濃度のNaOH溶液を作るには、放置した濃厚水溶液の上澄み液を取り、二酸化炭素を除去した水で適宜希釈する。作ったNaOH溶液はソーダ石灰を詰めた二酸化炭素吸収管を接続して保存する。標準物質としてアミド硫酸を用いブロモチモールブルー溶液を指示薬として標定する。」
<滴定曲線>
標定後空気中のCO2を吸収したNaOH溶液を滴定剤として用いて塩酸を滴定した場合の滴定曲線を求めます。
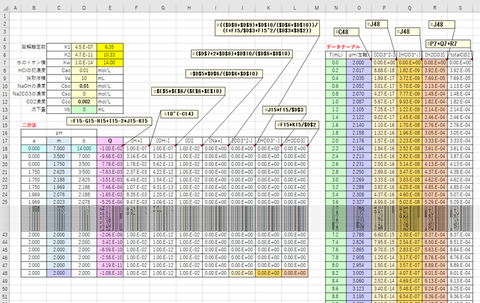
エクセルで滴定曲線を描く場合、「二分法」(2019/03/08)、「レビ法」(2019/03/12)などいくつかのやり方があります。二分法は滴下量を与えてpHを求める方法、レビ法はpHを与えて滴下量を求める方法です。レビ法を用いる場合は、pHの関数として滴下量の式(滴定曲線の式)を求める必要があります。
Cco mol/LのCO2を含んだCbo mol/LのNaOHを滴定剤として用い、Cao mol/LのHCl, Va mLを滴定する場合の滴定曲線の式(滴下量: Vb mL)は次式で与えられます(2021/04/18)。
Vb = Va(Cao-Δ)/(Cbo-(2f0+f1)Cco+Δ)
ここで、Δ=[H]-[OH]
f0 = [CO3]/Cc = 1/(1+[H]/K2+[H]^2/(K2K1))
f1 = [HCO3]/Cc = f0[H]/K2
Va/Vb(横軸)に対するpH(縦軸)の滴定曲線を描く場合は、
Vb/Va = (Cao-Δ)/(Cbo-(2f0+f1)Cco+Δ)
となります。
例題1 (1) 0 , (2) 1×10^-5 , (3) 3×10^-5
, (4) 1×10^-4 , (5) 3×10^-4 mol/LのCO2を含む0.01 mol/L NaOH溶液を滴定剤として用いて、0.01 mol/LのHClを滴定したときの滴定曲線と当量点のpHは?
エクセルを用いてレビ法でVa/Vb(横軸)に対するpH(縦軸)の滴定曲線を描くこととする。
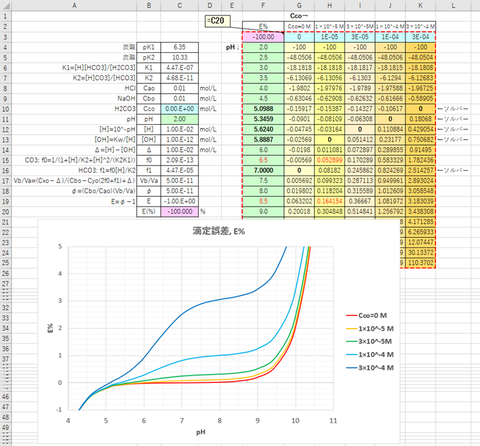
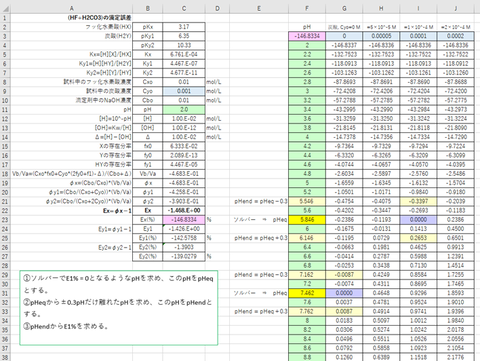
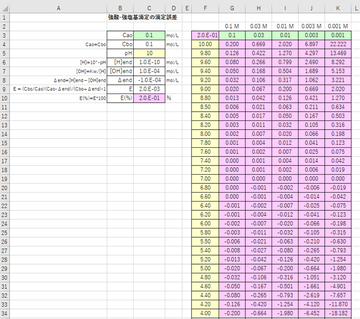
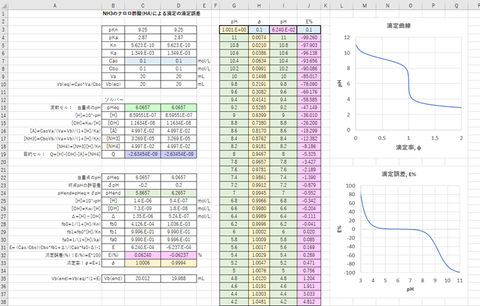
① あるCO2濃度(Cco
mol/L)およびpHについて、次式をもちいてVb/Vaを計算する(図-1のC列)。
Vb/Va = (Cao-Δ)/(Cbo-(2f0+f1)Cco+Δ)
② What-If分析のデータテーブル機能によってCcoおよびpHを変化させたときの複入力データテーブルを作成し、Vb/Vaを求める(図-1のF~K列)
③ データテーブルにおいてソルバー機能を用いて各CcoにおいてVb/Va=1となるようなpHを求める。このpHが当量点となる。
④ データテーブルを変形してVb/Vaに対するpHの値の表を作る(図-1のM~R列)。
⑤ ④の表(M~R列)から範囲を指定して散布図を作り、滴定曲線を描く。
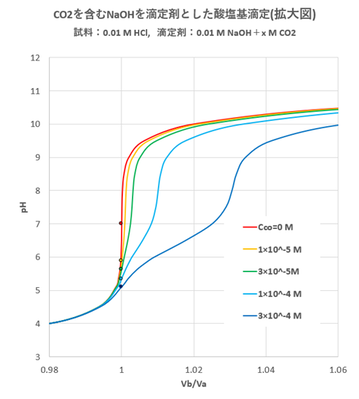
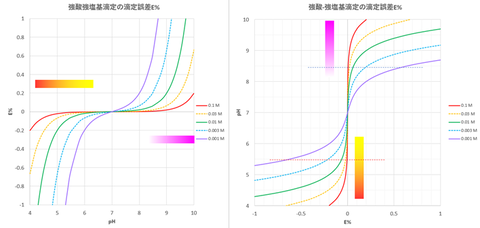
計算結果および滴定曲線を図-1、-2(拡大図)に示す。
図-1~2から明らかなように、滴定剤(NaOH)にCO2が微量でも混入すると、当量点のpHが7から5~6くらいまで低下することがわかる。
<滴定誤差>
Cco mol/LのCO2を含むCbo mol/LのNaOHを滴定剤として用い、Cao mol/LのHCl, Va mLを滴定する場合の滴定率をφ = CboVb/(CaoVa)とすると、滴定誤差(E=φend-1)は
E =φend-1= (Cbo/Cao)(Cao-Δend)/(Cbo-(2f0+f1)Cco+Δend)-1
となります(2021/05/02)。
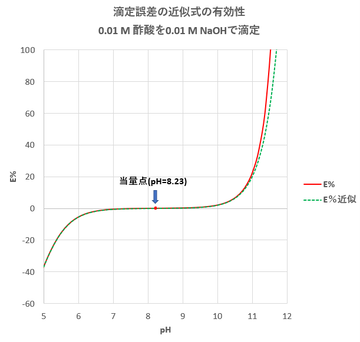
例題2 例1におけるpHと滴定誤差との関係は? また、例1の(2)
(Cco = 1×10^-5 mol/L)において、指示薬としてブロモチモールブルー(pHend=6.5とする)またはフェノールフタレイン(pHend=8.5とする)を用いた場合の滴定誤差は?
エクセルを用いてpHに対する滴定誤差E%を求める。
① あるCO2濃度(Cco
mol/L)およびpHについて、
E =φend-1=
(Cbo/Cao)(Cao-Δend)/(Cbo-(2f0+f1)Cco+Δend)-1
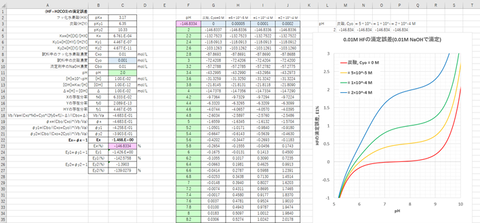
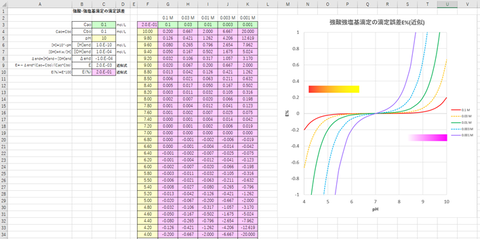
をもちいてE%を計算する(図-3のC列)。
② What-If分析のデータテーブル機能によってCcoおよびpHを変化させたときの複入力データテーブルを作成し、E%を求める(図-3のF~K列)
③ データテーブルにおいてソルバー機能を用いて各CcoにおいてE%=0となるようなpHを求める。このpHが当量点となる。
④ ③のデータテーブルから範囲を指定して散布図を作り、滴定曲線を描く。
計算結果およびpHと滴定誤差E%の関係を図-3に示す。
図-3から指示薬としてブロモチモールブルー(pHend=6.5)を用いたときの滴定誤差は、+0.053%、フェノールフタレイン(pHend=8.5)を用いたときの滴定誤差は、+0.16%となる。
二酸化炭素による滴定誤差を小さくするためには、指示薬としてフェノールフタレインよりもブロモチモールブルーを用いた方がよい。
<滴定曲線と二酸化炭素化学種の分布>
例題3 2×10^-3
mol/LのCO2を含む0.01 mol/L NaOH溶液を滴定剤として用いて、0.01
mol/LのHCl, 10 mLを滴定したときの滴定曲線とCO2の化学種分布は?
ここでは二分法を用いた。滴下量Vb mLに対応するpHと[CO3], [HCO3], [CO2]を求め、滴定曲線およびCO2の全濃度と化学種分布図を描く。結果を図-4、-図5に示す。
当然のことであるが、滴下量Vbの増加とともにCO2の全濃度は増加し、またpHの変化とともにCO2の化学種分布は変化する。